LDT 产品研发的技术思路
应该与 IVD 产品相同
体外诊断产品的研发注册,在严厉的审批监管之下,动辄几年的时间花费,百、千万的资金投入,从全社会角度来看,其优点在于,从机制上确保了上市产品的稳定、可靠、安全、有效。
但是在技术发展日新月异的今天,漫长的产品研发、审批周期很不利于新技术的探索性应用,不利于因当前临床常规无能为力,而处于“绝望”境地的患者从新技术中尽快获益。
而越是创新性强的产品,其技术标准,有效性评判标准都可能是史无前例,无所适从的状态。监管人员在责任压力之下,在审评中也只能小心翼翼,谨慎、谨慎、再谨慎。这就使新技术迟迟难以形成应用转化,迟迟无法造福于民的矛盾更为尖锐。
为了解决这个矛盾,国外已经摸索出了一条“实验室自建试剂(LDT)”制度。即,有良好技术能力,通过了一定资质监管认证的临床检验实验室可以利用最新的技术发展,自建检测技术方法,在自己内部投入临床检测应用。这样,以真实世界,有限范围内的探索性应用来逐渐摸索、印证新技术的有效性与各方面的利弊得失,即可快速解决当前的临床痛点,解决部分患者从最新技术发展中寻求希望的急需,又把创新发展过程中难以完全避免的各种风险局限在有限、可控范围之内。多年的事实证明,这是一条行之有效,利大于弊的技术管理方法。所以,国内的医疗监管机构当前也在向这个方向积极探索。
LDT体外诊断试剂的研发,没有药监局的审批监管,试剂的研发、配制不是在ISO13485,而是在 ISO15189质量体系之下实现。总体来说路径有所简化、标准的严格度有所降低,但整个产品研究、开发的方法逻辑过程与IVD产品应该是一致的。原理可行性研究、参考区间与阳性阈值的建立,各种质控方法与质控标准的研究、设立,都不能少。毕竟,对一个临床检测机构而言,无论使用LDT还是IVD检测试剂,保证检测的稳定、可靠、安全、有效性的要求是一样的。
生物标志物的寻找与发现
First in class 产品
一个体外检测诊断产品,最根本的创新是目标生物标志物的创新。发现一个新的目标生物标志物,就可以建立一个First in class产品。
为某种生理/病理状态寻找新的生物标志物至少可以存在着以下两种目的:
1.当前对某种生理/病理状态的诊断(综合)手段从指导临床的效果上是令人满意的,但在现实应用中存在着显著缺陷,可能创伤性太大,可能操作太繁琐,可能价格太昂贵……。所以新生物标志物的诊断效果不必超越现有诊断手段,只需避免现有手段的应用缺陷就可以。
2.当前对某种生理/病理状态的所有诊断手段综合起来,从指导临床的效能上仍不令人满意,希望对新生物标志物的发现可以从根本上提升对临床干预的指导效能。
生物标志物,是一种生物学属性,它与某种生理/病理状态具有稳定存在的内在关联性
才能成为其标志物。
我们如何得知这种关联性的存在呢?只能通过对这种生物标志物与某种生理/病理状态同时进行观测,寻找它们之间是否存在共同出现与共同消失的同步关系来确定。所以,我们只有具备了对两者同时观测的能力,才能感知它们之间关联性的存在(或不存在)。
基于这个道理,以上述第一种目的寻找新的目标生物标志物,在研究方法上是简单明确的。我们只需以现有诊断(综合)手段挑选所需阴、阳性样本,然后利用这些样本,建立、改进对假说目标生物标志物的检测技术。如果假说是正确的,即目标生物标志物与这种生理/病理状态确实具有稳定存在的内在关联性,当检测技术改进得足够好时,我们就可以把这种关联性鉴定出来,以前述产品研究与开发的方法建立新的诊断产品。这个新产品并不比此前的诊断手段在指导临床的效能上更高,但新的目标生物标志物检测诊断应该可以达到减小创伤性,简化操作,降低价格,等等优益应用目标。
以上述第二种目的寻找新的目标生物标志物时难度要大许多。此时,我们认为现有观测手段对这种生理/病理状态的感知能力不足。如果我们沿用常规方法,从“不足”的现有手段所得到的观测结果去关联新生物标志物的观测结果。这样得到的关联关系,其效度就不会超过这个“现有观测手段”,这就达不成我们寻找新的目标生物标志物的目的。此时,我们只有以患者临床转归的结局与新目标生物标志物测量结果做关联分析,来寻求比旧检测更好的关联度。而患者临床转归结局是受着多维度的已知、未知因素影响的,其中很可能存在复杂的逻辑干扰,所以这项工作注定十分艰难。
检测技术的改进提高
Me better 产品
如果目标生物标志物与某种生理/病理状态的关联是明确而令人满意的,但检测手段令人不满意,这是检测技术研发人员最有发挥余地的地方。
针对明确目标生物标志物检测的技术改进,无论以前述减小创伤性,简化操作,降低价格为目标,还是以提高检测灵敏度、特异性,改进亚型细分,进而更好地指导临床干预为目标,这样的 Me better产品,从研发到监管,到临床应用推广都是矛盾纠结最少的,值得企业重视。
体外诊断产品商业成功的关键要素
体外诊断试剂是一种特殊的商品,它的商业成功由多维度决定。
首先是科学性,这是一种体外诊断试剂合理、合法存在的伦理道德基础。唯其有科学性,它才能给患者带来临床受益,才不是骗子。体外诊断试剂产品的研制开发必须从科学性入手,从生物学原理到技术方法的建立,关键技术参数的选择,目标人群的选择与临床应用方式,获益人群的评估都必须以严谨的科学态度、科学方法去进行,才能保证这个科学性。
有了科学性,就有了产品利大于弊的基础。作为一种商品,就可以满足客户需求。而体外诊断试剂这样一种特殊的商品,需要从中获取利益的客户不止一个,按重要性排序,应该是患者、医生、检测实验操作者(实验员)。
患者必须成为获益的首要考虑,这也是一切医疗行的基本伦理原则。
患者获益最大化之后,才是其它一切利弊的考虑。
排在第二位需要获益的客户是医生,他们的利益本质上是与患者同一的,帮助它们解决难题也就是帮助患者。但与患者不同的是,它们需要承担医疗责任,检测产品使患者获益是由它们根据检测结果所作的干预决策而实现的。
实验员们是检测试剂的使用者,是产品的直接用户。产品的易用性、可靠性与它们的工作量、错误率直接相关,影响着检测质量,也关乎患者的利益。
在这个“感受为王”的时代,一个产品要想获得商业成功,客户体验是个必须重视的命题。虽然体外诊断产品最重要的受益者必须是患者,但对其应用感官体验最强的却是医生,使用或不使用这个产品的决定权也在医生。从样本获取、检测周期,到结果报告形式,临床意义解读,整个产品系统必须使临床医生感觉便利、顺畅、有助于他跟患者之间的沟通交流,帮助他消除患者的疑虑,而不能复杂、晦涩,引发患者质疑,给医生带来的麻烦比帮助还多。所以,体外诊断产品在用户感受体验方面,首要考虑的应该是医生,其次才是患者和实验员。
接下来是产品的成本、价格、利润这些一切商品都必须关注的问题。然后,是虽然放在最后提及,但从最开始就应该考虑,全过程丝毫不可忽视的,监管法规,行政许可,这是产品成为合法商品的基本基础。
创新体外诊断试剂产品发展中
各要素的互动关系
从显微镜的发明开始,体外诊断技术、产品的发展就是一项由技术进步推动,临床应用引领,二者交互促进的过程。
新技术的产生,改进、拓展了人们对生物学现象观测、测量的能力,这些新的观测与测量结果可以更好地反映、预示疾病的发展与转归,帮助临床选择最佳干预手段。而临床医疗中的各种难点、痛点又引导着检测技术的改进、提高,进而发现新的、更有效的生物标志物。
这个循环发展的主要参与者为临床医学专家(KOL),产品研发、生产企业,还有行政监管部门。最后,在临床医学专家们形成的专家共识、诊疗规范,与企业市场推广运作的共同作用下,由广大临床医生实现产品的大规模应用,即,商业成功。
体外诊断创新产品要想获得商业成功,各要素之间需要形成一个良好的互动关系。这个关系总结如下图。
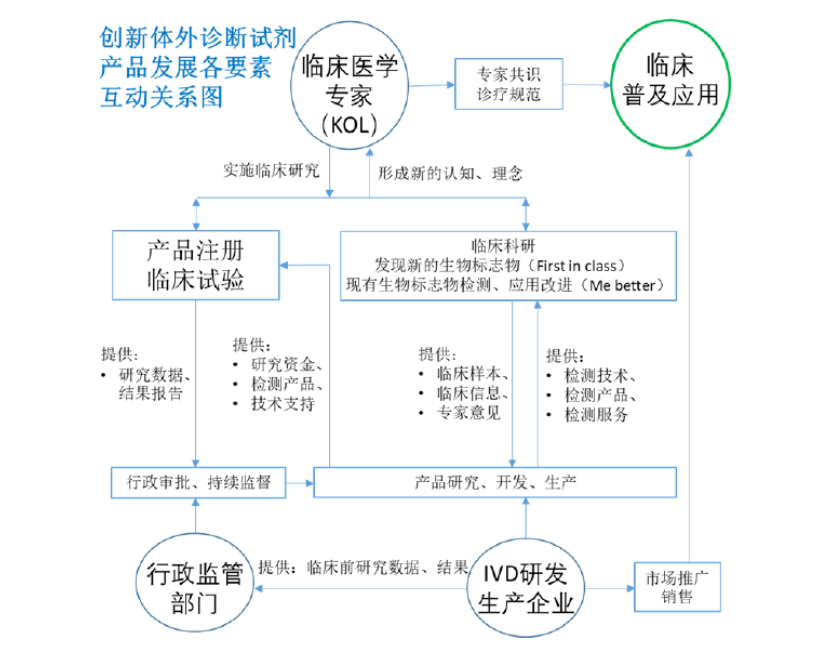
首先,新生物标志物的发现(可以形成First in class 产品)与现有生物标志物的检测、应用改进(可以形成Me better产品),都需要通过临床研究才可以实现。其实施主体只能是临床医学专家。
体外诊断试剂研发生产企业在这个过程中可以做的是实验方法学的建立和改进,提供检测技术、检测产品、检测服务。而企业要想做到这些,完成本文前述的产品研发过程,只能依赖于临床提供的生物样本与这些样本的背景临床信息。同时,企业还应与临床医学专家密切沟通,了解临床应用痛点,听取它们的意见和建议,才能建立对临床具有切实帮助作用的产品。
在临床科研过程中,临床专家也逐渐形成了对新的生物标志物,或现有生物标志物的改进检测,在临床应用中新的认知和理念。当这些新的认知和理念随着多中心、多维度、较长时间的临床研究,成熟到一定程度后,临床医学专家们就会将这些新的理念上升为专家共识与诊疗规范,以教育、指导广大医生们应用新的检测技术使更多患者受益。
与此同时,临床专家们还在企业配合下完成了产品的注册临床试验,将试验结果报告提交行政监管部门,与企业提交的临床前研究资料一起,接受监管审批。然后,在监管部门的持续监督下实现产品的稳定生产。至此,创新技术的临床转化与产品转化已经万事具备,只需企业的市场销售部门努力推广,实现产品的良好销售即可。
在上述互动过程中,有两个很容易成为瓶颈问题的关键要点需要产品研发总监与企业最高领导者高度重视。
首先是,临床医学专家们从多个个案研究结果到形成专家共识必然是个漫长、艰难的过程。一个企业的产品发展策略,必须要对此有所考虑。具体而言,寻找新的生物标志物,建立First in class产品固然是最高水平的创新,但彻底崭新的东西在初期必然会经历一个遭到广泛质疑的时期。即使有几个临床医学专家先知先觉,获得他们的力挺、支持,毕竟还是需要比较充分的循证医学证据之后才会获得普遍的行业认同。
循证医学概念出现近30年以来,“有效”的标准越来越高,多中心、大样本、随机对照、Meta分析已成为高等级医学证据的必须,而这些都需要经年累月的临床科研工作才可能获得。即使出现这些研究证据,莫衷一是的争论经常还会持续很久。因此,企业投入新的生物标志物、 First in class产品的研发,必须要做好“打持久战”的心理与资金准备。
以新的生物标志物去申请产品注册,也把监管审批人员推向一个颇有压力的境地:
这个产品的研发过程是否合理?
产品是否确实有效、稳定、是否可以使患者获益?
这些问题的评判标准与评判依据如何设置?
在没有先例可寻的情况下,他们面对这些难题只能采取最保守的态度,从各个角度去质疑,要求各种额外的研究证据,审批过程必然非常漫长、艰难。
另外,还有一个现实问题是:
对这个新生物标志物检测的技术门槛有多高?
咱们是否可以设置充分有效的知识产权壁垒?
如果检测技术难度不高,咱们又没有知识产权壁垒,或者别人可以绕过咱们的知识产权壁垒,那咱们与临床专家合作多年,辛苦收集研究数据,使这个新的生物标志物获得行业公认之后,却很可能被其它企业轻松产品化而获利。这种“替人做嫁衣裳”的事情,企业肯定是不愿意做的。
从实用主义角度, Me better产品或许是技术型体外诊断企业更好的研发目标。一个已经获得公认的生物标志物,但检测技术尚不理想,这正是研发技术人员可以有所作为的地方。此时,研发结果的优劣评判就是一个与既有检测相比较的纯技术问题,而不太涉及临床生理/病理等生物学层面的观念、认知。这样的检测改进,从临床医学专家到普通临床医生、行政监管人员都不会遇到很大的认知挑战,产品比较容易获得水到渠成的认可。
在研发过程中,咱们一旦率先找到特殊技术路径、窍门,如果可以设置专利壁垒固然好,即使无法形成专利壁垒,也可以用技术保密的方式维持技术门槛。毕竟这个“检测技术尚不理想” 能够存在到今天,必然有其内在技术难点没那么容易解决,别人跟进也得在咱们后面花一番功夫。
第二个问题是,无论是First in class还是 Me better产品,甚至Me too产品也不例外,产品开发中都需要良好、足量的临床样本,这些样本必须有充分、清晰的临床背景信息,各分组、亚型数目足够。否则,本事再大的研发人员,没有适当、足量的样本,也是“巧妇难为无米之炊”。
研发所需样本来源的限制,是体外诊断试剂行业形成所谓“赛道”差异的内在原因之一。临床样本只能来源于临床医学专家,不同细分专业的临床医学专家掌握着不同的生物样本。一个体外诊断产品企业,欲想从事一种临床专业的产品研发,从产品开发阶段就必须要与相应专业的临床专家合作才能获得所需的临床样本。那么,可以与哪些专业的临床医学专家建立良好的互信、合作、互助关系,就决定了这家企业可以在哪条“赛道”上发展。并且,产品研发成功后,还需要这些临床医学专家成为客户才能把产品卖出去,其中所需的互信合作关系不是朝夕之间可以建立起来的。所以,改换“赛道”是一家企业需要小心筹划,谨慎决策,长期实施、投入,但短期内难以获得很好回报的事情。
结语
以上按照体外诊断试剂产品研发、申报的逻辑顺序,把几年来的个人经验做了一个梳理。这些内容叙述起来必须有个先后条理,而在实际工作中,为了抢时间,争速度,很多工作是并发进行的。
而在特定进展状态下,哪些工作可以并发进行以提高效率,加快研发进度,哪些工作必须要等待前序工作完成才能开始,否则是做无用功,这些都需要研发项目的负责人有一个清醒的认识才能调度得当。
创新研发总是困难重重,前文中的“优化”、“试错”、“梯度设置”,说起来轻描淡写,做起来充满着失败与挫折。各项工作,艰难与顺利难以预测,主要矛盾、瓶颈环节持续动态变化,需要经常调整技术策略,资源力量,寻求当最佳对策。这就要求研发负责人对产品的科学原理、技术内核、研发路线、评审思维……都有精当、透彻的理解,才能随时做到批郤导窾,游刃有余地掌握研发进展,直至最后成功。
生物医药研发是一个依赖于漫长的学习、培训过程才能培养出合格人才的行业。这个行业的从业者都来源于学术科研机构,可学校里从不教给学生如何去做产品开发。所以一个刚出校门的人,不论学历多高,他是完全不能胜任注册体外诊断产品开发工作的,关键是从思想意识、思维方式、对法规的理解上不能胜任。他需要一个相当长的时间在工作中去逐渐体会、理解,才能完成从学生、学者到一个合格的产品开发工程师的转变。
老败自己也不例外,上过所有可以上的学,但课堂上从没听老师讲过产品开发。直接被扔到海里学游泳,所谓“Swim or Sink”。栽了无数跟头,掉了无数坑,连滚带爬地跟同事们一起做了几个创新型二代测序分子诊断产品的产品研究、开发,其中一个产品已经完成临床试验与注册申报、获批。
本文的经验总结就是为了帮助研发负责人们对持续几年的工作从一个宏观、系统的视角去观察,建立一个框架路线图,希望可以起到按图索骥的作用,初出茅庐的后来者如果看到,可以及早获得一些间接经验,对他们有所帮助。
后记
高中毕业以后,老败最初所受的专业教育是医学,具体而言是口腔医学。幸运的是,我们是最后一届6年制的医学本科生。在口腔专业学科,比如,口腔内科、外科、修复科的学习以外,我们有较充裕的时间学习各种基础知识,接受各种医学训练,包括各种化学(无机、有机、物理、分析、生物)、生理学、解剖学、组织学、微生物学、免疫学、统计学、病理学、诊断学、普通内科、普通外科、耳鼻喉科……。
在这期间,在我们华西当时的副校长,傅继梁教授的选修课上(《遗传分析导论》),老败听说了“二十一世纪是分子生物学的世纪”这个充满蛊惑力的口号,由此心生神往,决定弃医从(科)研。
本科毕业后,老败没去做医生,而是在协和医大,基础医学研究所的药理教研室做了一阵志愿者研究助理,参与了一些神经药理方面的科研工作,开始初步接触到分子生物学实验方法。90年代中期出国,硕士专业是生物技术(biotechnology),具体工作是乳酸菌的分子克隆改造,由此把各种分子生物学实验技术玩得滚瓜烂熟,并顺道学了点工业发酵的知识。博士专业是病原生物学(pathobiology),具体工作是以当时尚属前沿技术的基因芯片方法研究一种细菌的致病与免疫分子机制。由此对微生物学、传染病学、细胞生物学有了比较多的了解。2004年回国,在复旦大学上海医学院对乙肝病毒与宿主细胞的相互作用研究了三年,熟悉了一些病毒学知识。然后去到企业,做药物研发早期的临床前研究工作。再后来去到一家分子生物科研试剂的研发、生产企业工作,从研发与技术服务工作中熟悉了各种酶与蛋白的克隆、表达、纯化、各种核酸提取产品、各种PCR、RT-PCR、qPCR产品的研发生产、单抗制备、多抗制备,与各种蛋白检测、免疫检测产品的研发与技术服务,并开始接触到爆发式发展的高通量测序技术。
大约7年以来,老败参与了几个基于高通量测序技术的创新诊断试剂的产品研发。从科研探索到临床应用,从LDT到注册IVD,技术创新带来的前所未有的观测、测量能力,产出各类分子、生物信息,在很多时候已经超出了既往的临床经验认知。我们知道这些新产出的信息十分有用,但还不知道如何去用。在新的应用探索中,老败不得不开始关注辅助生殖技术、生殖发育、分子遗传、男科、妇科、产前诊断、宏基因组学、肿瘤检测、器官移植……。
有这样一种说法,达芬奇时代以前,个体人以一己之智力就有可能囊括所有的人类知识。达芬奇就是最后一个这样的人。从文艺复兴以后,人类知识大爆炸,没有人再能掌握一切知识,必须有所取舍、专业分工。那么,老败算是什么专业的?面对这个问题有点茫然,已然年过半百,自己算是什么专业的呢?向别人介绍自己的时候,老败通常自称是分子生物学与微生物学、细胞生物学专业的。其实分子生物学对老败一直是个工具,微生物学、细胞生物学在学校里关注过一段时间而已。最近十几年的工作内容,用“分子生物学应用技术”来概括比较恰当。近几年为之努力的体外诊断试剂研发就是这个“应用技术” 的一个具体方面。
老败年轻时一心要做科学,做什么样的科学并无专一志向。半生漂泊之后落在了体外诊断这一行,并非刻意,造化使然。将来还会飘向何方?先祖有方闲章,文曰:“平生踪迹尽由天”,正是老败写照。人生之路,“知道望乡看不见,也须一步一回头”。现在把最近这步的体会、感悟整理成文,作为人生的一个阶段性总结,特此为记。
来源:LDT Bioscience
作者:老败
如有其他问题请联系我们,竭诚为您解答~



