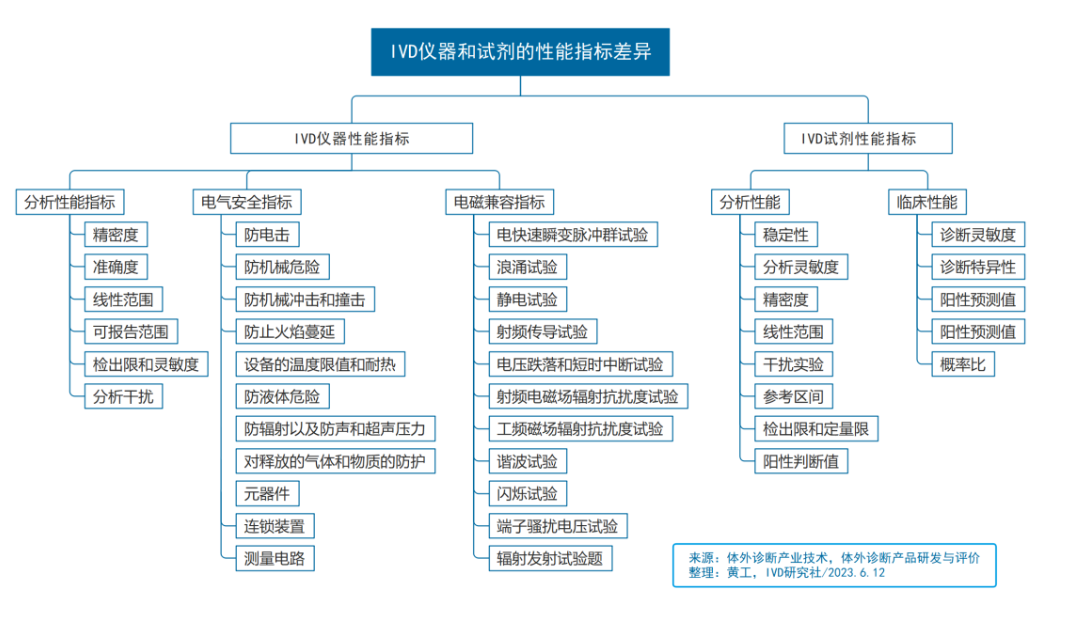
IVD仪器和试剂,研发差异
12个角度,探究两者区别:底层技术学科、技术方向、产业链结构、原材料和零部件、研发架构、产品分类、产品构成和形态、生产工艺、技术平台、性能指标、监管法规、上市周期。
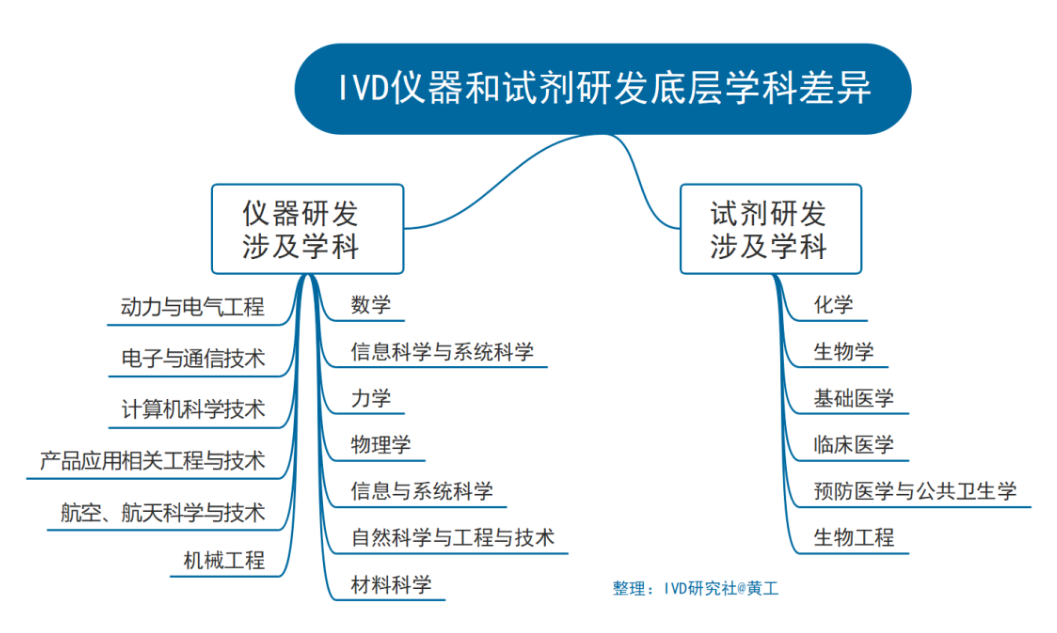
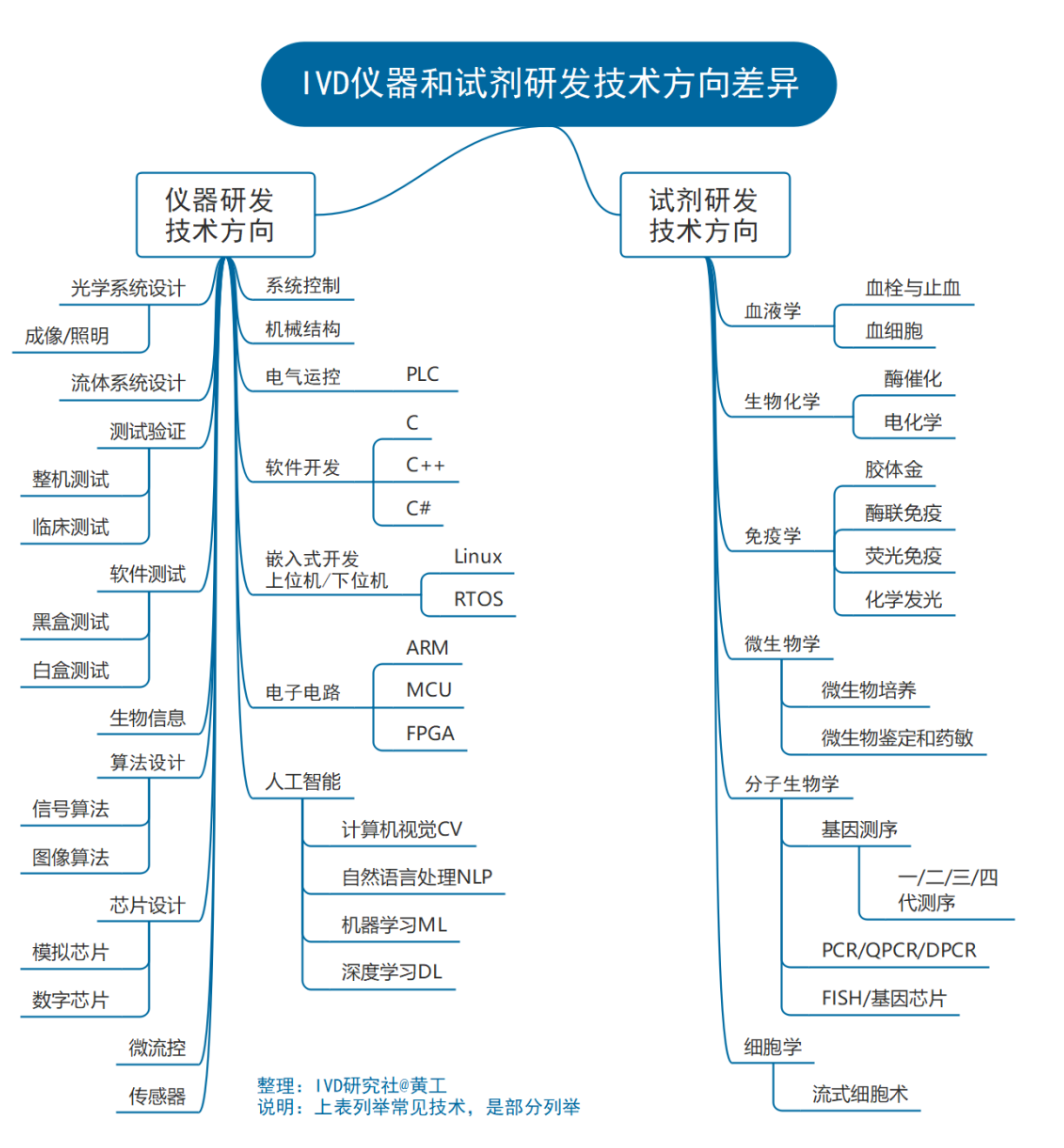
技术方向差异
产业链结构差异

原材料差异
机械零部件:①直线运动零件(无油衬套、手动位移台、直线导轨、拖链、轴承、关节轴承、直线电机、滚珠丝杠、支座组件),②传动零件(联轴器、同步带、同步轮、平皮带、圆皮带、滚轮、齿轮、齿条、链轮、链条、万向节和同步带压块),③气动元件(气源处理元件、真空发生器、真空压力开关、气动接头、调速阀类、气缸、控制阀、真空吸盘、气管软管),④铝型材及配件(铝合金型材及配件),⑤工业框体结构部件(手轮、拉手、门锁、滑轨、门部件、手柄、脚杯、铰链、脚轮、把手等,⑥机械加工件(连接块、检验夹具、转轴、导向轴、固定环、标准治具、支柱、底座、导向轴支座、定位零件、导向零件、悬臂销、铰链销等),⑦机械标准零件(弹簧、氮气弹簧、密封圈、磁铁、螺丝、螺帽、垫圈、轴环等),⑧其他(工业用材料、检测用零件)。
电子元器件:电阻、电容、电感、电位器、电子管、散热器、机电元件、连接器、半导体分立器件、电声器件、激光器件、电子显示器件、光电器件、传感器、电源、开关、微特电机、电子变压器、继电器、印制电路板、集成电路、各类电路、压电、晶体、陶瓷磁性材料、印刷电路用基材基板、电子功能工艺专用材料、电子胶(带)制品、电子化学材料及部品等,计算机芯片、存储芯片、电源芯片等。
电气元件:断路器、交流接触器、中间继电器、指示灯、接触器、热继电器、转换开关和行程开关、熔断器、按钮、指示灯、端子、节点、万能转换开关、行程开关等、线束等。
光学元件:激光器、滤光片、物镜、透镜、凹面平像场光栅、光电探测器、鞘流池、玻璃比色杯、棱镜、反射镜、LED、氙灯、聚光镜等。
流体零部件:采样针、穿刺针、清洗针、搅拌针、加热针,柱塞泵、注射泵、移液泵、无阀泵,电磁阀、分血阀、旋转阀、夹管阀、高压阀,冷凝器、散热器,卡环管、软管、翻边管、硬管、快插接头、单向阀、过滤器、平底接头、螺纹垫片、卡箍等。
(2)IVD试剂原材料:
(以下资料,来源于《中国体外诊断产业发展蓝皮书2019-2020年卷》)
①按照反应体系分类
核心原料体系:诊断酶、辅酶、抗原、抗体、引物、探针等
信号体系:胶体金、酶底物系统、荧光/发光物质等
反应载体系统:NC膜、酶标板、磁珠、微球等 反应环境体系:生物活性材料、精细化学原料,如牛血清白蛋白、阻断剂、缓冲盐
②按应用领域分类
生化诊断原料:酶(乳酸脱氢酶、肌酐酶、胆固醇氧化酶、酮氨氧化酶等59个品种),辅酶(NAD、NADH、NADP、NADPH、CoA、Thio-NAD等20种),底物(Glupa-C、Gal-G2-GNP、EPS、CNP-AFU等9种)、抗原抗体(C反应蛋白多抗、肌红蛋白多抗、D-二聚体单抗等常用30多种),胶乳等
免疫诊断原料:核心是抗原抗体(感染类、心肌标志物类、肿瘤标志物类、激素类、自免抗原等),碱性磷酸酶、辣根过氧化酶,发光底物(APS-5、AMPPD、鲁米诺等),微球
分子诊断原料:前处理酶(蛋白酶K),核心酶原料(Taq DNA聚合酶、逆转录酶、UDG酶等100多种),PCR、RT-PCR预混液,dNTP等5种脱氧核糖核苷酸,NGS原料(T4连接酶、Klenow片段、Tn5转座酶等10余种),探针引物,磁珠
凝血诊断原料:S2238、凝血因子、巴曲酶等常用30多种
生物传感器酶:葡萄糖氧化酶、葡萄糖脱氢酶、尿酸酶等19种,底物(乳酸、胆碱等)


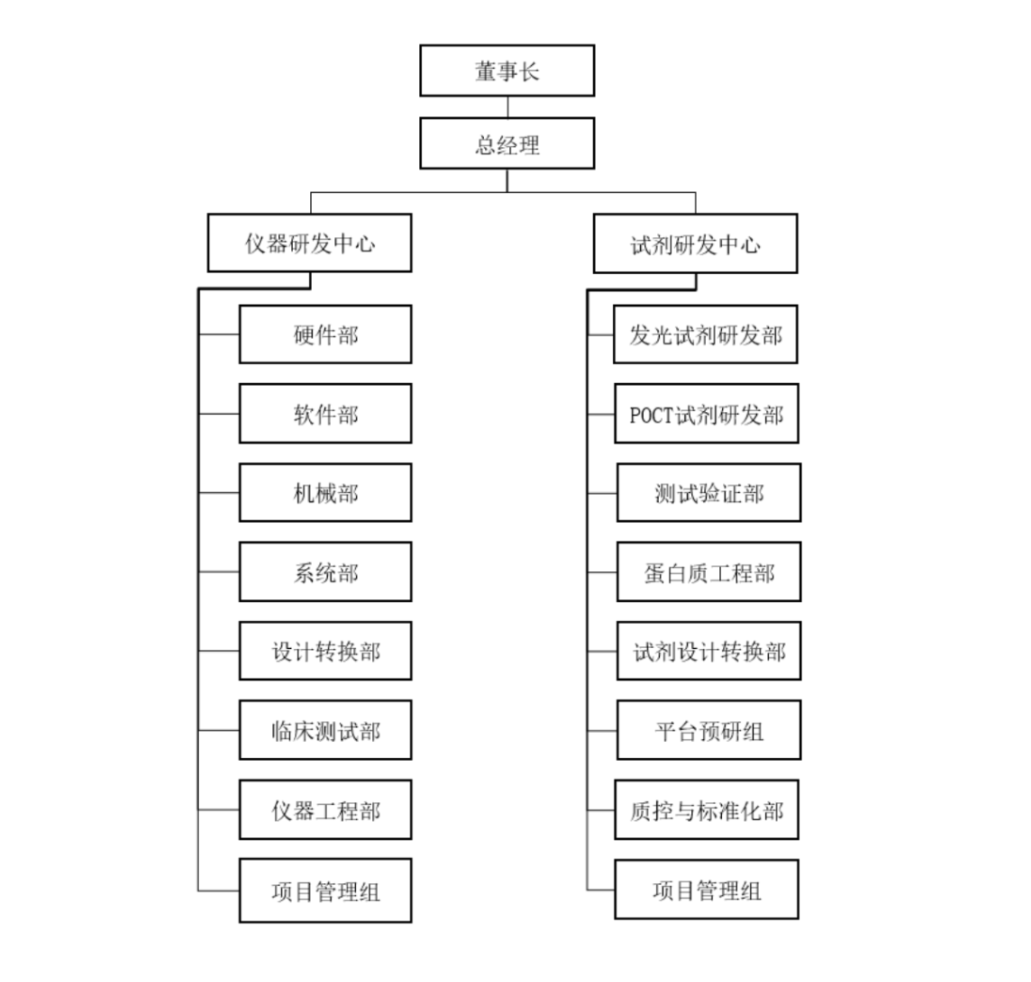
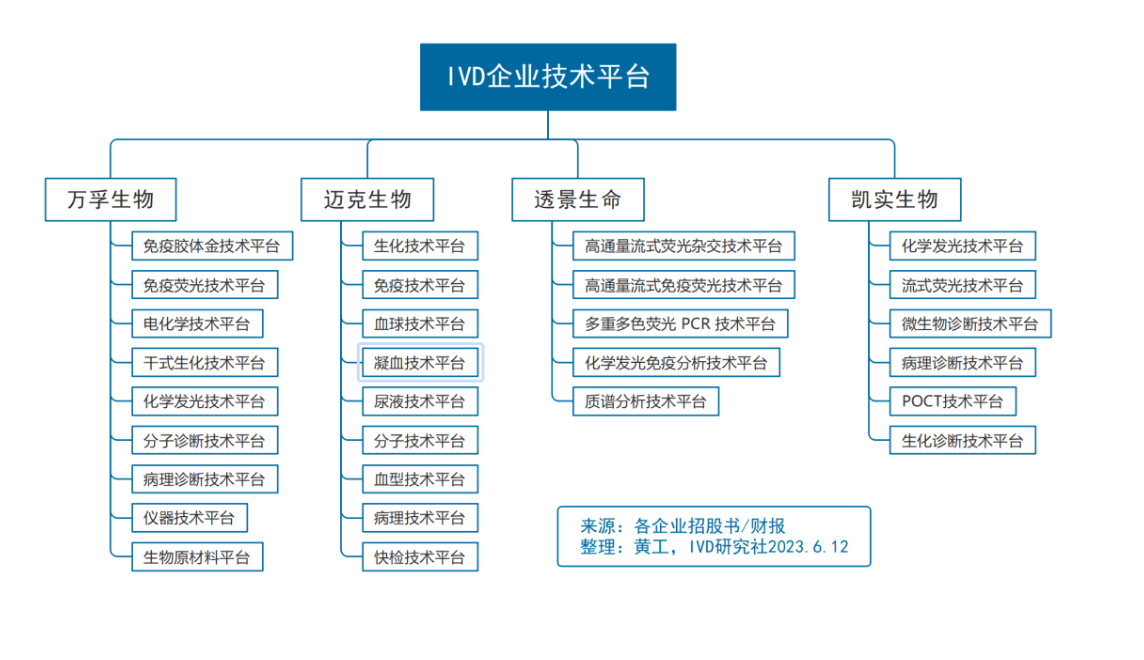
(1)IVD仪器生产流程
一般会经历,生产领料,对仪器元件、零部件等物料,进行质量检查。然后进行组件装配,机架安装、布线、布管,再进行整机组装。组装完成后,对仪器功能进行检查调试,再对仪器进行整机测试、性能测试、老化测试等等。测试通过后,进行外壳安装、整机检查,全部合格后打包入库,等待出货。

(上图来源:嘉兴凯实招股书)
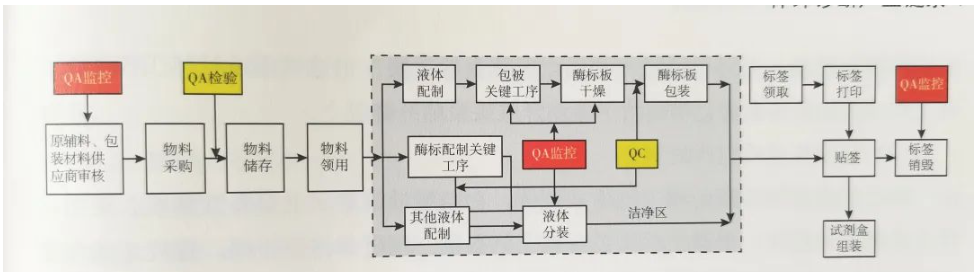
(2)试剂生产流程
(以下资料来源:2022体外诊断科技创新发展报告)
生化试剂生产
生化试剂的生产,包括各种工作溶液的配置、分装及包装等步骤,并通过产品的半成品检验和成品检验两个质控过程,保证期质量符合规定。

酶联免疫试剂生产
生产流程包括,各种工作溶液的配置、包被酶标板反应板、分装及包装等步骤。并通过半成品和成品检验两个质控过程,来保证其质量符合规定。
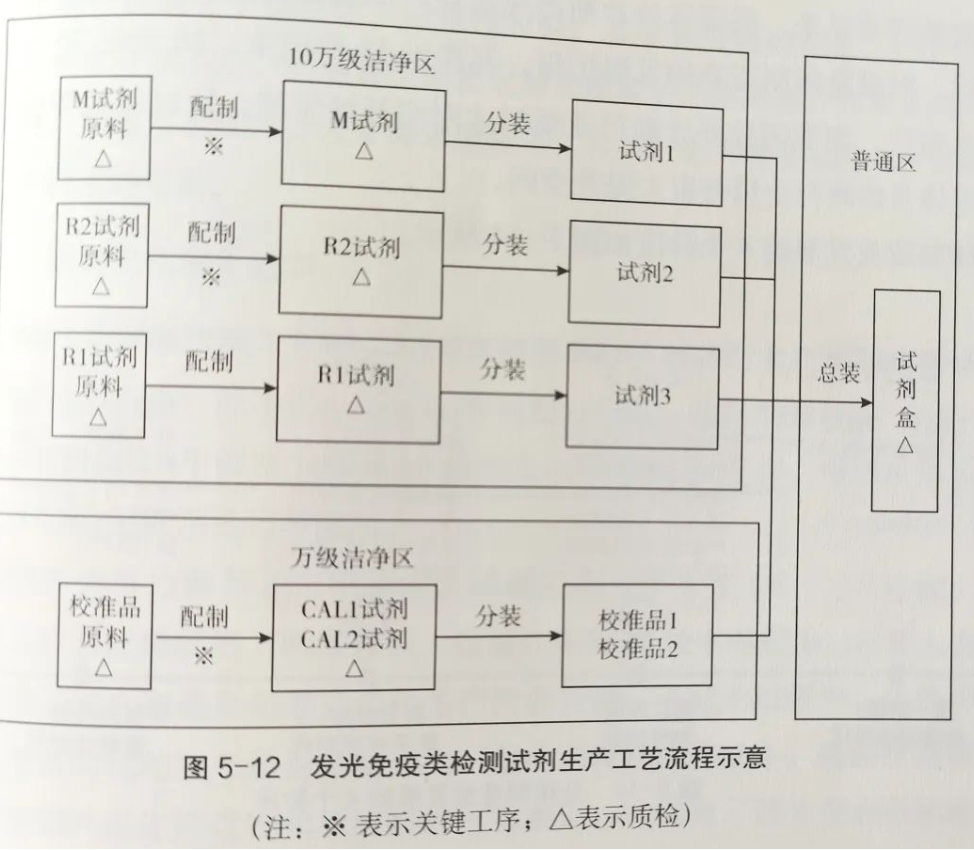
化学发光试剂生产
化学发光试剂生产,包括包被反应板、标记物制备、各种溶液的配置、冻干、分包装等步骤,并通过产品的半成品检验和成品检验两个质控过程,来保证其质量符合规定。
监管法规差异
一、二、三类,是根据产品风险等级划分,一类、二类到省药监局备案注册,三类到国家药监局(NMPA),医疗器械技术审评中心(CMDE)注册,即审评六部。这是《医疗器械监督管理条例》规定的。
仪器,三类至少3年,二类2年左右,一类1年左右。仪器上市周期,因产品和项目复杂程度,差异较大。若是大公司,前期有成熟产品线、技术平台和研发团队,研发推进会快一些。消耗时间较多的,是注册阶段。型检、整改、发补等,会来回折腾。

试剂,三类3~5年,二类2~3年,一类1年左右。而试剂上市周期,最消耗时间的,则是型检和临床。型检一般由注册部门负责。IVD大型企业,有自检资质的,可以自主进行。这是2021年10月发布的政策,资质由国家局、省局认可。
三类试剂,有些送到北京检验所,依托第三方验证。需将仪器和试剂打包送检。那三类试剂临床试验,一般也需要8-10个月,至少需要入组上千个病例。像一些小众的疾病,若一家医院病例不够,还需要反复协调,和更多医院增加入组。当然,也有捷径。国家药监局,制定了创新医疗器械特别审批程序,为一些技术创新性产品、急需上市产品,开通了绿色通道,极大缩短了上市周期。比如,近几年的新冠检测仪器和试剂,属于三类,按常规上市周期,至少3年。

来源:IVD研究社



